Dieta ketogeniczna, czyli dieta wysokotłuszczowa o zminimalizowanej do 20 – 50 g na dobę podaży węglowodanów jest ceniona za swoje unikatowe właściwości prozdrowotne. Od kilkudziesięciu lat wiele wiadomo na temat możliwości łagodzenia napadów padaczkowych w przebiegu padaczki lekoopornej. Ostatnio coraz więcej wiadomo na temat korzyści ze stosowania tego modelu żywienia w przebiegu insulinooporności, cukrzycy typu 2 czy otyłości. Dietę ketogeniczną wymienia się także w kontekście wspomagania terapii nowotworów. Co na temat takiego zastosowania diety keto mówią badania kliniczne?
Dieta ketogeniczna – czym wyróżnia się na tle innych sposobów żywienia?
Dieta ketogeniczna ogranicza spożycie węglowodanów i zwiększenia podaż tłuszczów. Jednak dieta ketogeniczna nie jest po prostu dietą niskowęglowodanową – w czasie jej stosowania pojawia się stan ketozy. W diecie ketogenicznej organizm uczy się korzystać z tłuszczów jako podstawowego źródła energii, a towarzyszy temu nasilona synteza ciał ketonowych. One także mogą być wykorzystane przez mózg jako źródło energii. Ciała ketonowe – aceton, acetooctan oraz beta hydroksymaślan – występują u każdego w ilościach nie przekraczających 0,2 mmol/ l. W stanie ketozy stężenie ciał ketonowych wielokrotnie wzrasta.
Dieta ketogeniczna opiera się na tłuszczach i wspomaga spalanie tkanki tłuszczowej. Pozornie wydawać mogłoby się, że to swoisty paradoks – w jaki bowiem sposób spożywanie tłuszczów może przyczynić się do efektywnego spalania tkanki tłuszczowej? Wyjaśnienie jest bardzo proste – wystarczy znajomość przebiegu kilku przemian metabolicznych w organizmie. Podczas stosowania diety ketogenicznej możliwe jest unormalizowanie poziomu glukozy i insuliny we krwi, co wynika z ograniczenia spożycia węglowodanów i braku ciągłej stymulacji trzustki do syntezy insuliny. W efekcie możliwe jest efektywne spalanie tłuszczu – zarówno tego dostarczanego wraz z dietą, jak i zgromadzonego w organizmie pod postacią depozytów tkanki tłuszczowej. A umożliwia to utrzymanie fizjologicznego stężenia insuliny, gdyż hormon ten – poza regulowaniem gospodarki węglowodanowej – wpływa także na przemiany tłuszczów. Wysoki poziom insuliny we krwi – towarzyszący tradycyjnemu modelowi odżywiania – promuje zjawisko lipogenezy, czyli odkładania tkanki tłuszczowej. Z kolei niski poziom insuliny sprzyja procesom lipolizy – spalania tkanki tłuszczowej.
Podsumowując – diecie ketogenicznej towarzyszy stan prawidłowej glikemii, czyli poziomu glukozy we krwi, a także insuliny; jednocześnie wzrasta stężenie ciał ketonowych. Ma to ogromne znaczenie nie tylko dla utrzymania prawidłowej masy ciała. Dieta keto doskonale sprawdza się w leczeniu takich zaburzeń gospodarki węglowodanowo – insulinowej jak insulinooporność i cukrzyca typu 2, a także w profilaktyce chorób układu sercowo-naczyniowego. Ale nie tylko – uzyskanie wyjątkowego stanu metabolicznego sprawia, że dieta ketogeniczna może stanowić uzupełnienie terapii nowotworów. A w przebiegu chorób nowotworowych także dochodzi do pojawienia się charakterystycznych odrębności metabolicznych – a najistotniejszą z nich jest wysokie zapotrzebowanie komórek nowotworowych na glukozę.
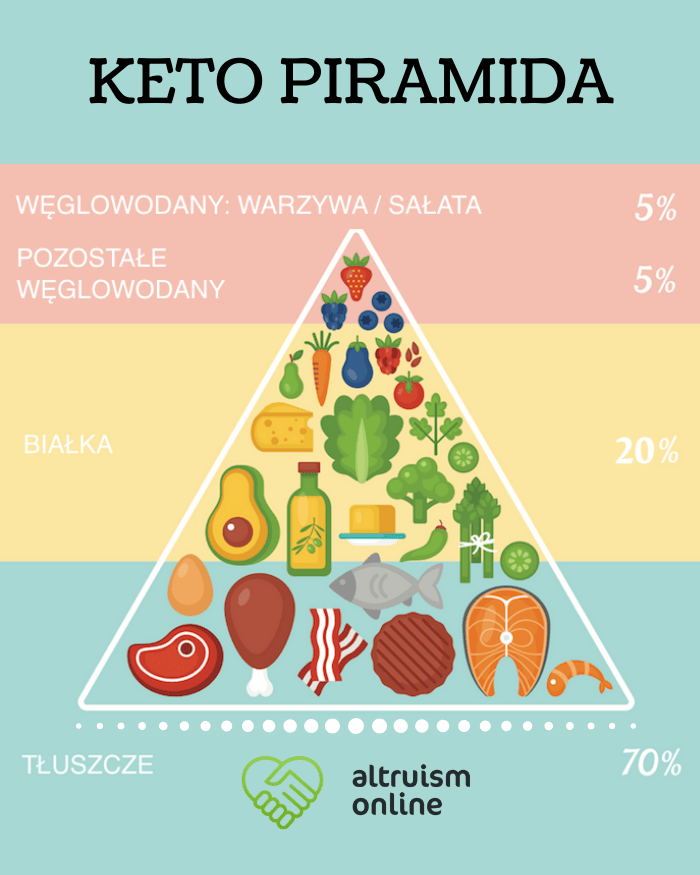
Odmienność metaboliczna komórek nowotworowych – dlaczego dieta może mieć znaczenie?
Istnieje wiele cech wyróżniających komórki nowotworowe na tle prawidłowych komórek ciała. Przede wszystkim – komórki te mają zdolność do niekontrolowanych podziałów komórkowych, co umożliwia szybki wzrost guza. Komórki nowotworowe cechują się ponadto utratą zdolności do starzenia się, a także możliwością tworzenia odległych przerzutów. Kolejną cechą odróżniającą komórki nowotworowe jest ich nasilony metabolizm. Szybkie namnażanie się komórek wymaga stałego dostępu do związków energetycznych – i w tej roli najlepiej sprawdza się glukoza. Teorię o wysokim zapotrzebowaniu komórek nowotworowych na glukozę wysunięto już 100 lat temu – mowa o teorii Warburga. Komórki nowotworowe wykorzystują glukozę jako źródło energii, jednak preferują przemiany beztlenowe – znacznie mniej wydajne niż przemiany tlenowe. Oznacza to wysokie zapotrzebowanie na glukozę; w oczywisty sposób pojawia się zatem pytanie, czy znaczne ograniczenie spożycia węglowodanów (trawionych finalnie do glukozy) może przyczynić się do zahamowania wzrostu guza?
Faktem jest, że stosowanie diety ketogenicznej zmniejsza dostępność glukozy do procesów glikolizy w komórkach nowotworowych. Komórki nowotworowe tracą zatem podstawowe źródło energii. Ale to nie jedyny efekt. Zahamowanie procesu glikolizy wiąże się ze spadkiem syntezy NADPH – związku odpowiedzialnego m.in. za ograniczenie syntezy wodoronadtlenków lipidowych. Te produkty peroksydacji lipidów odpowiadają za dysfunkcję i dezintegrację błon komórkowych. W komórkach nowotworowych generowany jest stres oksydacyjny, co może prowadzić do nekrotycznej śmierci komórek nowotworowych. Na zwiększenie stopnia peroksydacji lipidów w komórkach nowotworowych wpływa także bezpośrednio zwiększenie stężenia acetooctanu. I wreszcie – dieta ketogeniczna sprzyja modulowaniu składu flory bakteryjnej jelit, co przyczynia się do wzmożonej syntezy w świetle jelit krótkołańcuchowych kwasów tłuszczowych. Związki te wraz z ciałami ketonowymi wpływają na transkrypcję genów odpowiedzialnych za procesy naprawy DNA. Dzięki temu dieta ketogeniczna może zwiększyć wrażliwość komórek rakowych na chemio – i radioterapię.
Okazuje się, że stan hiperinsulinemii, towarzyszący m.in. insulinooporności, cukrzycy typu 2 czy otyłości, ale także diecie wysokowęglowodanowej może promować rozwój nowotworów. Insulina jest bowiem hormonem, który nie tylko normalizuje poziom glukozy we krwi, ale także stymuluje wzrost komórek. W komórkach nowotworowych obserwowana jest nadekspresja receptorów dla insuliny, co przekłada się na przyspieszony wzrost guza. Ostatecznie – osoby z hiperinsulinemią są bardziej narażone na rozwój nowotworów, ponadto są bardziej obciążone większą śmiertelnością związaną z rakiem. Stosowanie diety ketogenicznej, która uznawana jest za model żywienia najbardziej sprzyjający utrzymaniu prawidłowego poziomu insuliny we krwi, może zatem stanowić jeden z wielu elementów prewencji raka.
Ciała ketonowe, których zwiększona synteza towarzyszy stosowaniu diety ketogenicznej, także mogą wpływać na zahamowanie rozwoju guza. Przede wszystkim – komórki nowotworowe nie są w stanie wykorzystać ciał ketonowych jako źródła energii, a efekt Warburga zachodzi ze znacznym nasileniem zwłaszcza w komórkach przerzutujących. Ciała ketonowe – jak wykazały badania in vitro – hamują proliferację komórek nowotworowych. Potwierdzenie tych obiecujących badań in vitro uzyskano w testach na zwierzętach. Myszom ze wszczepionymi komórkami nowotworowymi podawano ciała ketonowe w postaci suplementu. Wzrost guza monitorowano in vivo i po zakończeniu badania wykazano, że suplementowanie ciał ketonowych przedłużyło żywotność myszy.
Dieta ketogeniczna a nowotwory – co mówią badania na zwierzętach?
Nie brakuje analiz oceniających wpływ diety ketogenicznej na rozwój nowotworów i przebieg terapii onkologicznej. Cennych informacji dostarczają m.in. testy na zwierzętach. W jednym z badań stosowano dietę ketogeniczną u myszy z gruczolakorakiem jelita. Zastosowanie modelu żywienia, w którym 80% kalorii pochodzi ze średniołańcuchowych kwasów tłuszczowych skorelowane było ze spadkiem masy guza nowotworowego. W innym badaniu u myszy ze wszczepionym guzem żołądka porównano wpływ stosowania diety ketogenicznej oraz standardowego modelu żywienia. W grupie zwierząt stosujących dietę ketogeniczną odnotowano spowolnienie wzrostu guza oraz wydłużenie czasu przeżycia zwierząt. Kolejne badanie dotyczyło wpływu diety ketogenicznej na zwierzęcy model raka prostaty. U zwierząt stosujących tradycyjny model żywienia czas przeżycia był krótszy niż u zwierząt stosujących dietę ketogeniczną, ponadto w tej grupie zwierząt tempo wzrostu guza było znacznie większe. Podobne wyniki badań uzyskano w badaniach na zwierzętach z guzem mózgu, okrężnicy czy płuc.

A co ze stosowaniem diety ketogenicznej u pacjentów onkologicznych?
Nowotwór jest bez wątpienia chorobą, która narzuca konieczność stosowania odpowiedniego modelu żywienia. Proces nowotworowy wyzwala kaskadę zdarzeń, które stopniowo prowadzą do stanu wyniszczenia organizmu, określanego mianem kacheksji. Mowa m.in. o takich czynnikach jak:
- nasilona synteza cytokin prozapalnych, nasilająca procesy katabolizmu mięśni, w efekcie których dochodzi do zmniejszenia masy mięśniowej, a tym samym – spadku tempa metabolizmu
- wzmożona synteza kwasu mlekowego przez komórki nowotworowe, co prowadzi do zaburzeń łaknienia, nudności i wymiotów
- szybkie zużywanie ustrojowych zapasów energetycznych
- wymioty i biegunki będące efektami ubocznymi leczenia onkologicznego
- wydzielanie przez guza hormonów mogących wpływać na ośrodek głodu i sytości
Odpowiednia strategia dietetyczna u pacjentów cierpiących na nowotwory ustalana jest indywidualnie, w oparciu o aktualny stan zdrowia chorego. Właściwy model żywienia ma na celu wzmocnienie organizmu, a także wspomaganie terapii onkologicznej. Jedną z rozważanych opcji może być dieta ketogeniczna.
Wciąż jeszcze dostępnych jest bardzo mało badań klinicznych dotyczących stosowania diety keto w celu spowolnienia postępu choroby nowotworowej. Obiecujące wyniki uzyskano u chorych na glejaka – złośliwy nowotwór mózgu o niekorzystnym rokowaniu. Komórki glejaka charakteryzują się wysokim tempem przemian glukozy, co znajduje wyraz w wytwarzaniu znacznych ilości kwasu mlekowego. W odróżnieniu od prawidłowych komórek mózgu, które mogą czerpać energię z ciał ketonowych, komórki glejaka pozbawione są takiej możliwości. Pojawiła się zatem teoria, że ograniczenie podaży węglowodanów w diecie może przyczynić się do spowolnienia funkcji życiowych komórek glejaka. Wyizolowanie metaboliczne komórek zmienionych nowotworowo oraz wykorzystanie ich silnej zależności od glukozy pozwala na zaprojektowanie terapii ukierunkowanych na metabolizm glukozy – i w takiej roli może sprawdzić się dieta ketogeniczna. Jako zalety takiej terapii wymieniany jest przede wszystkim brak toksyczności i występowania efektów ubocznych. A co ze skutecznością takiej terapii?
Pojedynczych pacjentów cierpiących na glejaka, poddano tradycyjnej terapii, uzupełnionej o stosowanie diety ketogenicznej, w której 90% energii dostarczały tłuszcze. Uzyskano zadowalające wyniki badań, ze szczególnym uwzględnieniem jednego przypadku. Mowa o 65 – letniej pacjentce, u której uzyskano całkowitą regresję guza. Bardzo obiecujące były także efekty wdrożenia diety ketogenicznej u dwóch pacjentów pediatrycznych ze złośliwym guzem mózgu. Już po 7 dniach stosowania diety ketogenicznej zauważono zmniejszenie wychwytu glukozy przez komórki nowotworowe w mózgu. U jednego z pacjentów zaobserwowano poprawę nastroju, a kontynuowanie diety przez dalsze 12 miesięcy przyczyniło się do zahamowania progresji choroby.
Korzyści ze stosowania diety ketogenicznej sprowadzają się także do zwiększenia wrażliwości komórek nowotworowych na leczenie chemioterapeutykami. Stosowanie niskokalorycznej diety ketogenicznej u zwierząt chorych na neuroblastomę przyczyniło się do wydłużenia czasu przeżycia.
Dieta ketogeniczna a nowotwory tarczycy
W badaniach in vitro i in vivo na komórkach raka tarczycy wykazano, że zastosowanie diety ketogenicznej może przynieść wymierne korzyści. Myszom ze wstrzykniętymi komórkami raka podawano standardową karmę lub zastosowano dietę ketogeniczną. W grupie zwierząt stosującej dietę keto wzrost guza był wolniejszy. Natomiast w badaniach in vitro wykazano, że w środowisku o niskim stężeniu glukozy komórki raka tarczycy namnażały się wolniej niż w środowisku o wysokim stężeniu.
Dieta ketogeniczna a nowotwory przewodu pokarmowego
W badaniu na myszach, którym wprowadzono podskórnie komórki nowotworowe linii gruczolakoraka żołądka oceniano wpływ diety ketogenicznej na progresję nowotworu. Jedna grupa zwierząt karmiona była standardową dietą, a u drugiej grupy zastosowano dietę ketogeniczną. W tej drugiej grupie wykazano znacznie wolniejszy wzrost guza.
Dieta ketogeniczna a rak piersi
Wpływ diety ketogenicznej na przebieg raka piersi zbadano na grupie 60 kobiet dotkniętych tym schorzeniem. U 30 kobiet z rakiem piersi zastosowano przez 3 miesiące standardową dietę, a u kolejnych 30 – dietę ketogeniczną. Po zakończeniu analizy wykazano, że dieta ketogeniczna przyczyniła się do wydłużenia czasu przeżycia.
Dieta ketogeniczna a rak prostaty
W badaniach na myszach z wszczepionymi komórkami raka prostaty, u których zastosowano dietę ketogeniczną, wykazano o ponad 30% mniejszy wzrost guza niż w grupie zwierząt na tradycyjnej diecie.

Dieta ketogeniczna w profilaktyce chorób nowotworowych
Diety o ograniczonej kaloryczności są uznawane za rozsądną strategię terapeutyczną, mającą na celu zmniejszenie ryzyka chorób przewlekłych, w tym raka, a także wydłużenie życia. Dieta ketogeniczna wyróżnia się kilkoma cechami, które mogą uczynić z niej godny polecenia element profilaktyki nowotworów. Oczywiście – jest to tylko jedna z zalecanych strategii, gdyż w celu zminimalizowania ryzyka rozwoju nowotworów konieczne są bardziej różnorodne działania. W jednej z dużych analiz, która obejmowała grupę ponad 274 tysięcy mężczyzn i 275 tysięcy kobiet wykazano, że wysoki poziom glukozy we krwi skorelowany jest z większym ryzykiem rozwoju nowotworów. Każdy wzrost poziomu glukozy o 1 mmol/ l powyżej normy przyczynił się do zwiększenia ryzyka rozwoju raka o 5% u mężczyzn i aż o 11% u kobiet.
Dieta ketogeniczna różni się od pozostałych sposobów odżywiania znacznym ograniczeniem spożycia węglowodanów, co generuje szereg zmian metabolicznych. Umiarkowane spożycie białka może przełożyć się na łagodzenie stanów zapalnych oraz ograniczenie rozwoju guzów nowotworowych. Ponadto zminimalizowanie spożycia węglowodanów pozwala na unormalizowanie poziomu glukozy i insuliny we krwi, a także insulinopodobnego czynnika wzrostu IGF – 1. Zarówno insulina, jak i IGF – 1 mogą pobudzać proliferację komórek nowotworowych i hamować apoptozę. Ponadto pozbawienie komórek dostępu glukozy przekłada się na generowanie energii z tłuszczów, co sprzyja syntezie ciał ketonowych. Takie zmiany metaboliczne pozwalają na zmniejszenie ilości wolnych rodników i zredukowanie stresu oksydacyjnego, co stanowi kolejny czynnik mogący ograniczyć nasiloną proliferację komórek.
Nie od dziś wiadomo, że otyłość traktowana jest jako jeden z czynników ryzyka rozwoju nowotworów. Wynika to m.in. z następujących mechanizmów:
- otyłości bardzo często towarzyszy insulinooporność; wykazano związek pomiędzy wysokim poziomem insuliny we krwi a wzrostem ryzyka nowotworu piersi u kobiet po menopauzie, a także pomiędzy wysokim poziomem insulinopodobnego czynnika wzrostu IGF – 1 a rozwojem raka jelita grubego u mężczyzn
- syntetyzowana przez tkankę tłuszczową leptyna powiązana może być z większym ryzykiem rozwoju raka okrężnicy oraz raka piersi
- wydzielane przez tkankę tłuszczową adipokiny (TNF alfa, adiponektyna, Il – 6) mogą odgrywać rolę w rozwoju raka prostaty, okrężnicy
- otyłości towarzyszy przewlekły stan zapalny, który powiązany może być z większą częstością występowania taka jelita grubego oraz prostaty
Jednym z kluczowych elementów profilaktyki nowotworów może być zatem utrzymanie prawidłowej masy ciała – a w tym pomocna okazuje się być dieta keto. Spożywanie wartościowych tłuszczów oraz zredukowanie podaży węglowodanów promuje pozyskiwanie energii właśnie z tłuszczów, pozwala zapanować nad napadowym głodem i zapewnia długotrwałe uczucie sytości, dzięki czemu redukcja nadmiarowych kilogramów jest znacznie prostsza.
Jeśli szukasz ciekawych pomysłów na posiłki zgodne z filozofią diety ketogenicznej – kliknij tutaj i sprawdź proste w przygotowaniu keto przepisy, które z pewnością przypadną Ci do gustu.








